Wat is organische chemie toch een interressant vak! De reacties in het boek werken echt. Met koolstofatomen en onder meer: waterstof-, stikstof- en zuurstofatomen zijn miljoenen verbindingen te maken. En: zijn in de natuur miljoenen verbindingen gemaakt. Lego voor volwassenen. Maar wel volwassenen die van doorbijten weten. Want, ja: het is wel een apart vak. In het begin zie je door de bomen het bos niet. Veel nieuwe begrippen....
Organische chemie is de scheikunde van koolstof. Koolstof komt in de natuur voor als diamant en als grafiet. Diamant maar heel heel weinig. In diamant heeft ieder koolstofatoom 4 bindingen met een ander koolstofatoom. Grafiet komt veel meer voor. Ieder koolstofatoom heeft dan 3 enkele bindingen. Het 4e elektron kan een dubbele binding maken of beschikbaar zijn om elektrische stroom te geleiden. In het laboratorium worden ook andere structuren van puur koolstof gemaakt: grafeen, buckyball, nanotube.

Diamant bestaat uit zuiver koolstof waarbij elk koolstofatoom een binding met een ander koolstofatoom heeft. Diamant is het hardste materiaal ter wereld. Het heeft een heel hoge brekingsindex. Daardoor weerkaatst diamant veel licht (in plaats van het licht na breking door te laten). Om verschillende redenen heel waardevol materiaal.
Grafiet bestaat ook uit zuiver koolstof. Nu heeft ieder koolstofatoom een binding met één ander koolstofatoom. Elk atoom heeft dus een p-elektron over. Deze geven π-bindingen. Maar deze elektronen zijn ook beschikbaar voor elektrische geleiding. Dat de pi-bindingen zwak zijn blijkt ook uit het feit dat grafiet een smeermiddel is. De koolstofplaatjes schuiven gemakkelijk over elkaar
Grafeen is een fullereen maar als plat molecuul met de dikte van 1 atoom.... Elk atoom heeft weer een elektron over. In het model hierboven zijn ze weergegeven als pi-bindingen (de dubbele bindingen). Maar de elektronen zitten heel losjes in deze bindingen. Door de bijzondere eigenschappen zoeken fabrikanten van elektronica naar toepassingen: oprolbare beeldschermen, transistoren, touchscreens enz.
De nanotube is ook een fullereen. Wetenschappers zijn in staat om van koolstof heel bijzondere moleculen te maken. Het nano-buisje is daar een voorbeeld van. Het nano-buisje is buitengewoon sterk, licht en elektrisch geleidend.
In graphene the musical wordt een aantal kwaliteiten van grafeen bezongen....
Methaan
Verbindingen van koolstof met andere atomen zijn er - zoals gezegd - miljoenen. Maar de allereenvoudigste verbinding staat model: methaan. In methaan heeft het koolstofatoom 4 enkele bindingen met 4 waterstofatomen. Koolstof heeft 4 valentie-elektronen. Elk atoom kan 4 bindingen aangaan.
Ethaan, etheen en ethyn
Het eerstvolgende molecuul in de reeks van koolwaterstoffen heeft 2 koolstofatomen. Er zijn dan 3 mogelijkheden: de beide koolstofatomen hebben....
* 1 binding > ethaan
* 2 bindingen > etheen
* 3 bindingen > ethyn
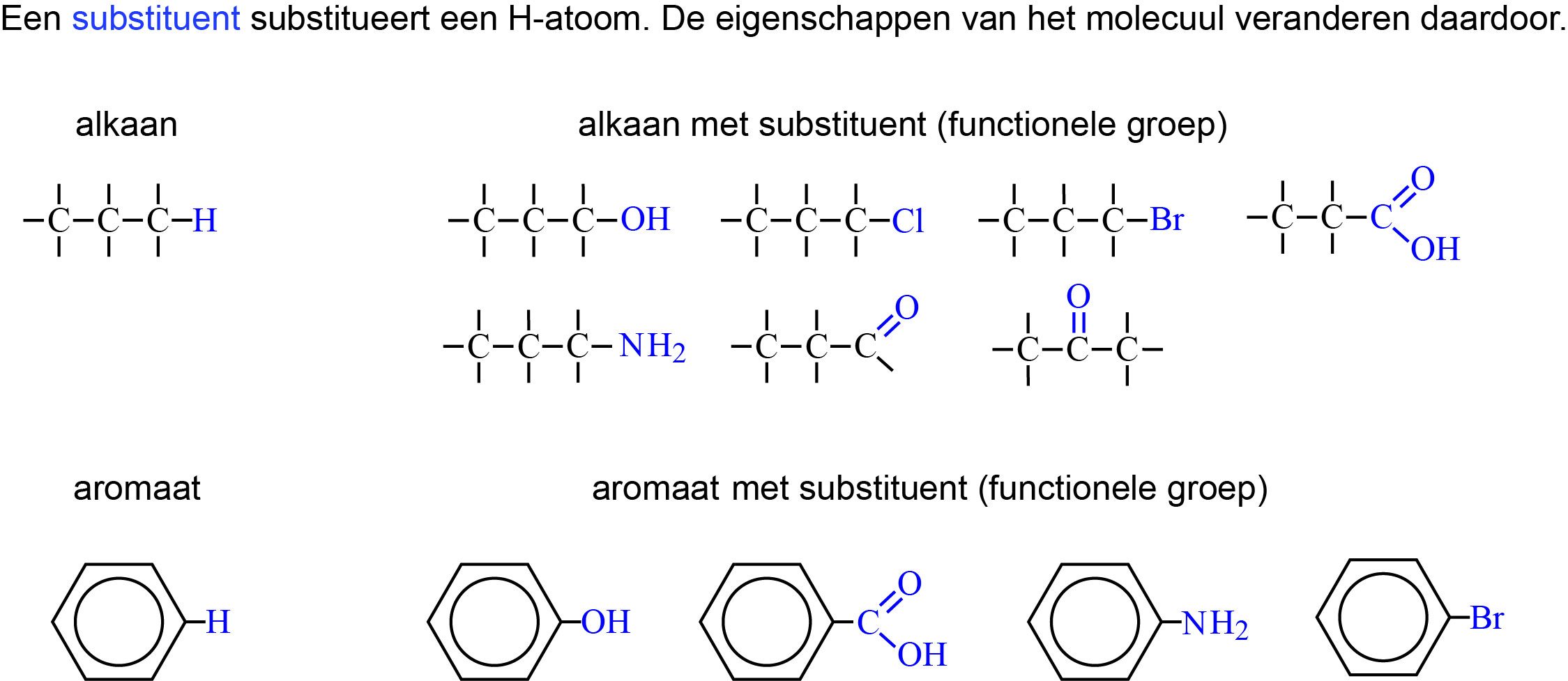
Functionele groep (substituent)
Er zijn duizenden koolstofverbindingen met alleen de atomen koolstof en waterstof. Maar vervangen we één of meer waterstofatomen door een substituent of functionele groep, dan zijn er ineens nog veel meer moleculen mogelijk.