Trillende atomen in een molecuul absorberen infrarode straling als de trillende atomen een dipool hebben. De frequentie van de straling is gelijk aan de frequentie van de trillende atomen. Een IR-absorptiespectrum van een stof heeft daardoor karakteristieke absorpties. Je kunt zien welke atomen of atoomgroepen aanwezig zijn. Je kunt dus conclusies trekken over de structuur van de moleculen.
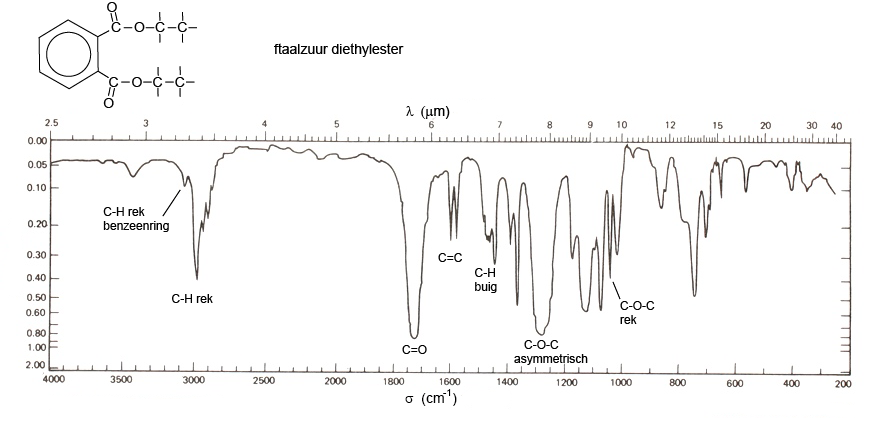
Hieronder staat het absorptiespectrum van de diethylester van o-ftaalzuur. In het spectrum is te zien dat de moleculen.....
-een benzeenring hebben (niet zo gemakkelijk te zien),
-alkylgroepen hebben,
-een C=O groep heeft (het zijn er twee maar dat kun je in het spectrum niet goed zien),
-een C-O-C groep heeft.
Er is nog meer te zien maar het is evengoed niet eenvoudig om conclusies te trekken. Computerprogramma's met bibliotheken met spectra van bekende stoffen helpen hierbij. Het blijft werk voor specialisten.
Metingen doe je met een dubbelstraals dispersie instrument of met FTIR. Een dipersie-insrtument meet op de klassieke manier: een monster wordt gescand, golflengte voor golflengte meet je de transmissie (of extinctie). Zo ontstaat in enkele minuten een absorptiespectrum. De FTIR meet alle golflengten tegelijk. Er ontstaat een interferogram, dat met "Fourier-analyse" wordt omgezet tot een absortiespectrum. Zie boek voor een uitgebreidere beschrijving.
In elk geval is het nodig watervrij te werken. Water absorbeert namelijk ook IR-straling en lost de cuvetten op. De cuvetten zijn gemaakt van zouten als KBr, NaCl, CsCl2. Dit is nodig omdat glas, kwarts en kunststof ook teveel IR absorberen en de meting dus storen.
Eenvoudige uitleg en wel in het Nederlands. Weliswaar gaat deze uitleg over dubbelstraals dispersiemeting en niet over FTIR:IR.
Een heel goed Engelstalig filmpje (FTIR) dat een en ander nog eens laat zien.... zie je hier.
En verder......
