- De reactiesnelheid is:
- concentratieverandering per seconde
- tijd nodig voor de reactie
- energie nodig voor de reactie
- orde van de reactie
- Bij een exotherme reactie ...
- is de enthalpie positief
- is warmte nodig
- komt warmte vrij
- is de activeringsenergie negatief
- Een reactie kan explosief verlopen als de reactie ...
- exotherm is met een lage activeringsenergie
- endotherm is met een lage activeringsenergie
- endotherm is met een hoge activeringsenergie
- exotherm is met een hoge activeringsenergie
- Als we de temperatuur verhogen, dan verloopt een reactie sneller. Waardoor wordt dit veroorzaakt?
- de orde van de reactie neemt toe
- de verdelingsgraad wordt groter
- de katalysator wordt actiever
- er zijn meer en krachtiger botsingen
- De reactiesnelheidsconstante (k) hangt onder meer af van:
- katalysator, aard stof, concentraties
- aard stof, concentraties, temperatuur
- concentraties, temperatuur, katalysator
- temperatuur, katalysator, aard stof
- Wanneer zijn reagerende deeltjes met elkaar in dynamisch evenwicht?
- als alle concentraties aan elkaar gelijk zijn
- als de reactie naar rechts aflopend is
- als de reactie heen even snel verloopt als de reactie terug
- als de reactie naar links aflopend is
- Een reactie is van de 2e orde als de ...
- reactiesnelheidscontante afhangt van 2 concentraties
- reactiesnelheidscontante afhangt van 4 concentraties
- reactiesnelheid afhangt van 2 concentraties
- reactiesnelheid afhangt van 4 concentraties
- Chemische reacties verlopen via een overgangstoestand.
Zie bijgaande afbeelding.
Door welke letter wordt hierin de activeringsenergie aangegeven?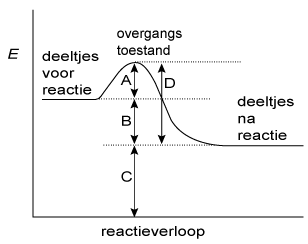
- A
- B
- C
- D
- We brengen wat vast AgCl in water. Er lost een heel klein beetje op.
Evenwicht: AgCl(s) <---> Ag+(aq) + Cl-(aq)
We voegen nog een beetje AgNO3 toe.
Wat gaat er gebeuren met de chloride-concentratie [Cl-]?- deze blijft gelijk
- deze wordt groter
- deze wordt kleiner
- deze wordt eerst kleiner en daarna weer groter.
- Bij volumevergroting van een gasmengsel in evenwicht, verschuift het evenwicht ...
- niet want K is constant
- naar de endotherme kant
- naar de kant met de minste deeltjes
- naar de kant met de meeste deeltjes
- We voegen een Fe(III)-zout toe aan water. De pH van het water houden we op 7,00.
Evenwicht: Fe(OH)3(s) <----> Fe3+ + 3 OH-
K = 2,8 x 10-39
Hoe groot kan [Fe3+] maximaal zijn?- 2,8 x 10-18 mol/L
- 2,8 x 10-39 mol/L
- 1,0 x 10-10 mol/L
- 3,3 x 10-8 mol/L
- Bij temperatuurverhoging verschuift het evenwicht ...
- naar de endotherme kant
- naar de exotherme kant
- niet want K is constant
- naar de kant met de meeste deeltjes
- In water hebben we het volgende evenwicht:
HF + H2O <---> H3O+ + F-
Als je door water toe te voegen het volume vergroot is er geen evenwicht meer, in de concentratiebreuk ...- is dan de noemer te groot en teller te klein
- is dan de teller te groot en noemer te klein
- zijn teller en noemer beide te klein
- zijn teller en noemer beide te groot
- Gegeven het evenwicht:
2 CO + O2 <----> CO2 + Q kJ/mol
Om het evenwicht naar rechts te verschuiven kunnen we ...- CO2 toevoegen
- afkoelen
- volume vergroten
- O2 wegnemen
- We lossen methaanzuur (HCOOH) op in water. 0,10 mol per liter.
Evenwicht: HCOOH + H2O <---> H3O+ + HCOO-
We meten de pH: 2,4
Hoe groot is de evenwichtsconstante? (Bereken eerst [H3O+] en dus [HCOO-] enz.)- 1,6 x 10-4
- 0,0040
- 251
- 6,3 x 105