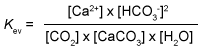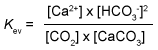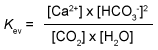- Een katalysator heeft invloed op de ...
- waarde van Kev
- warmte-uitwisseling
- insteltijd van het evenwicht
- ligging van het evenwicht
- De reactie
Ce4+ + Pb2+ -----> Ce3+ + Pb4+
is als volgt kloppend:- Ce4+ + Pb2+ -----> Ce3+ + Pb4+
- 2 Ce4+ + 3 Pb2+ -----> 2 Ce3+ + 3 Pb4+
- 2 Ce4+ + Pb2+ -----> 2 Ce3+ + Pb4+
- Ce4+ + 2 Pb2+ -----> Ce3+ + 2 Pb4+
- Bij welk evenwicht hoort deze concentratiebreuk?
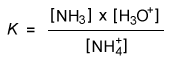
- NH4+ + H2O <---> NH3 + H3O+
- NH4+ <---> NH3 + H3O+
- NH4+ + H3O+ <----> NH3 + H2O
- NH4+ <----> NH3 + H3O+ + H2O
- 25 mmol NO2 (gas) en 20 mmol N2O4 (gas) zijn in een vat van 2000 ml met elkaar in evenwicht:
2 NO2 <---> N2O4.
Bereken de waarde van Kev.- 32
- 0,016
- 0,80
- 64
- Bariumhydroxide lost enigszins op en splitst daarbij in ionen:
Ba(OH)2(s) <----> Ba2+(aq) + 2 OH-(aq)
Men meet de hydroxide-ionenconcentratie: 0,020 mol/L
Bereken de waarde van Kev- 4,0 x 10-6
- 2,5 x 105
- 2,0 x 10-4
- 8,0 x 10-6
- Lithiumfluoride is bij kamertemperatuur niet heel goed oplosbaar. De evenwichtsconstante voor het oplosevenwicht is: Kev = 5,0 x 10-3.
Hoe groot wordt de lithiumconcentratie, [Li+] in mol/L?- 7,1 x10-2 mol/L
- 2,5 x 10-3 mol/L
- 5,0 x 10-3 mol/L
- 2,5 x 10-5 mol/L
- Wanneer is de reactie naar rechts aflopend?
- dan is Kev gelijk aan nul
- dan is Kev gelijk aan 1
- dan is Kev heel klein
- dan is Kev heel groot
- Kalksteen (CaCO3) lost op in CO2 houdend water. Bijvoorbeeld in kalksteengrotten.
Evenwicht:
CaCO3(s) + CO2(aq) + H2O(l) <----> Ca2+(aq) + 2 HCO3-(aq)
Welke evenwichtsvoorwaarde is voor dit evenwicht de juiste? -
- Nikkelcarbonaat (NiCO3) is slecht oplosbaar in water.
Als we een beetje vaste nikkelcarbonaat in het water brengen dan ontstaat het volgende evenwicht:
NiCO3 <----> Ni2+ + CO32-
We meten de (vrije) carbonaatconcentratie: 8,1 x 10-5 mol/L.
Hoe groot is blijkbaar de evenwichtsconstante?- 4,1 x 10-9
- 6,6 x 10-9
- 8,1 x 10-5
- 1,6 x 10-4
- Mierenzuur (methaanzuur) geeft met water een evenwicht:
HCOOH + H2O <----> HCOO- + H3O+
We maken bij kamertemperatuur een oplossing van 0,100 mol mierenzuur in een liter waterige oplossing.
We meten de pH: 2,38
Hieruit berekenen we de concentraties [HCOO-] en [H3O+]
Hoe groot is Kev?- 1,8 x 10-4
- 4,35 x 10-2
- 1,74 x 10-5
- 5,55 x 103